研究内容
I. エボラウイルス感染機構の解明
エボラウイルスはその高い病原性から、早急に制圧が望まれる病原体の1つであるにも関わらず、現時点においてエボラウイルス感染に対する有効な治療法は実用化されておりません。さらに、野生型エボラウイルスの取り扱いはBSL-4に限定されていることから、エボラウイルスの生活環、そして病原性発現に関する知見については、まだ不明な点が数多く残されています。私たちは現在、エボラウイルスの侵入およびウイルス粒子形成機構の解明を目指して研究に取り組んでいます。今後、長崎大学に設置予定であるBSL-4施設で野生型エボラウイルスを取り扱う利点を最大限生かして、現在取り組んでいる研究を進展させることで、エボラウイルスの病態発現機構の解明、そして新規治療薬の開発を目指します。
1. エボラウイルス侵入機構に関する研究
ウイルス感染阻害薬の開発において、細胞への侵入機構は重要な標的の1つです。私たちは、蛍光標識したエボラウイルス粒子を用いて、ウイルス侵入を可視化する系を開発し、エボラウイルスがエンベロープタンパク質依存的にマクロピノサイトーシスを介して標的細胞に侵入することを世界に先駆けて証明しました(Nanbo et al. PLoS Pathog, 2010)。一方、リン脂質の1つであるホスファチジルセリン(PS)受容体がエボラウイルスの侵入に関与することが解明されつつあります。PSは正常細胞の形質膜の内膜に局在することが知られています。エボラウイルスが産生される際に、形質膜をエンベロープとして獲得することから、何らかのメカニズムによって、PSがエンベロープ外膜に集積することが示唆されていました。私たちは、エンベロープへのPS集積に関与する宿主因子として、スクランブラーゼ(Xkr8)を同定しました(Nanbo et al. PLoS Pathog, 2018)。現在、このプロセスに関わる分子機構の解明に取り組んでおり、本研究を進展することでエボラウイルス感染機構に関する新しい知見を提供したいと考えています。さらに、私たちが開発したウイルス侵入を可視化する系を利用して、共同研究者と共に、エボラウイルス侵入を標的とした新規治療薬の開発、中和抗体の作用機序の解明にも取り組んでいます(Isono et al, Antivir Research, 2020, Furuyama et al. Sci Rep, 2016, Kuroda et al. J Virol, 2015)。
2. エボラウイルス粒子形成に関する研究
エボラウイルスが複製する際に、ウイルス因子やゲノムが細胞内でどこに局在し、新しい粒子が作られるのかについては明らかにはされておりませんでした。これに対し、私たちは組換えエボラウイルス感染細胞での個々のウイルス因子の細胞内動態を時空間的に追跡することに成功しました(Nanbo et al. Sci Rep, 2013)。この研究成果によって、このプロセスに関与する宿主因子の探索およびこれを標的とした創薬開発の可能性が示されました。エンベロープウイルスは一連の生活環において宿主細胞の生体膜を巧みに利用することで、子孫ウイルスを産生しますが、ウイルス感染における宿主細胞の膜動態の変動に着目し、体系的に検証した報告はほとんどありません。私たちは、エボラウイルス産生の際に、宿主細胞のリサイクリング小胞輸送系が関与することを明らかにしました(Nanbo et al. J Infect Dis, 2018)。この研究成果を受けて、現在、ウイルス粒子形成時における細胞の膜動態の役割ならびにその分子基盤を解明するため解析を進めています(論文投稿中)。
II. Epstein-Barrウイルス(EBV)感染機構の解明
ヒトγヘルペスウイルス亜科に属するEBVは、唾液を介して小児期に初感染し,成人の95%に感染が認められる普遍的なウイルスです。EBVは、ほとんどの場合において症状を示しませんが、一部の例ではバーキットリンパ腫や胃がんなどのがんを引き起こすことが知られています。私たちは、EBV関連がん発症機構の分子基盤を解明することを目的として、様々な観点から研究を進めています。
1. EBV感染細胞が放出する細胞外小胞エクソソームの機能に関する研究
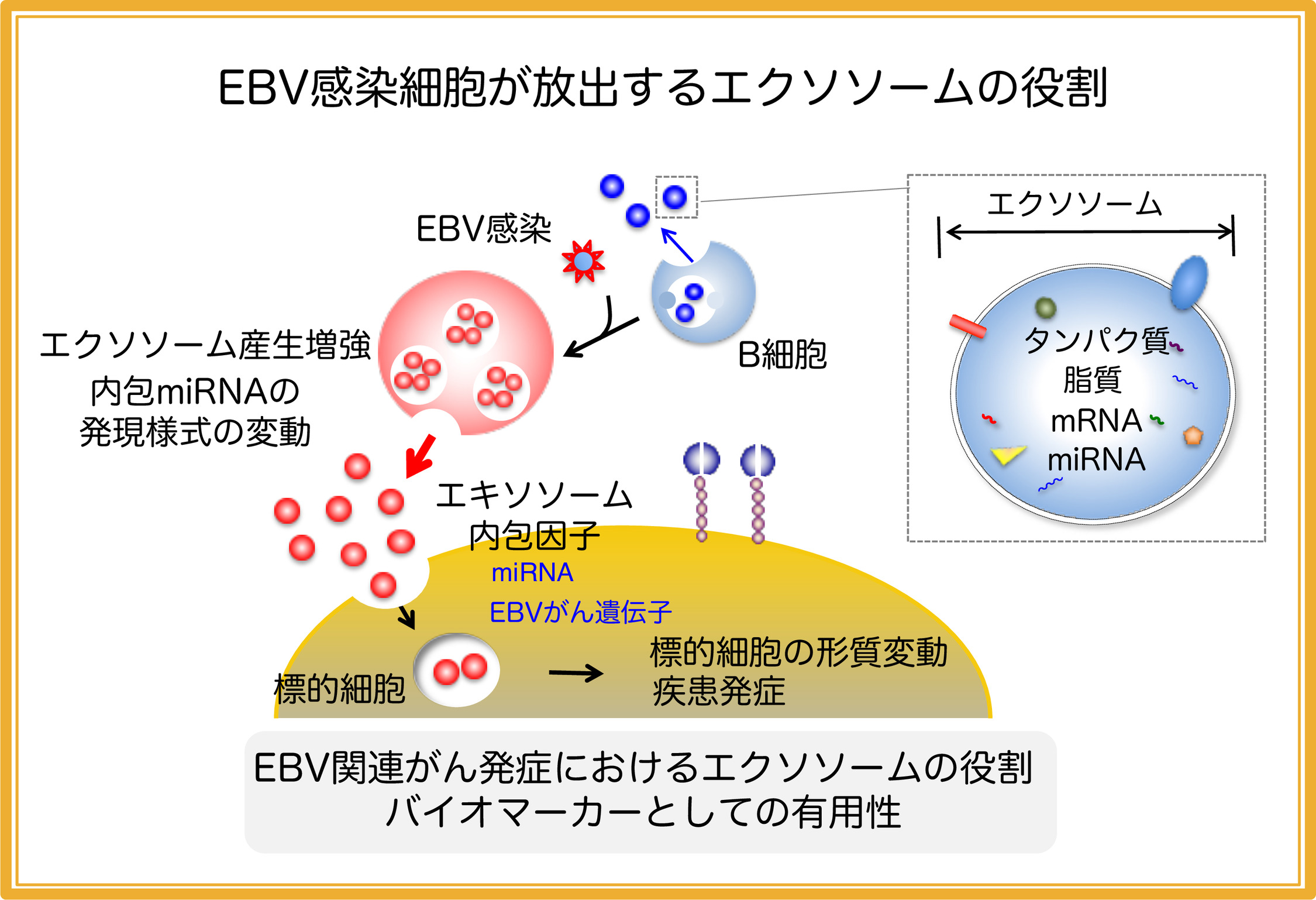
近年、EBV感染細胞が放出する、エクソソームと称される細胞外小胞の役割に注目が集まっています。エクソソームは、内包された様々なタンパク質や核酸を輸送することで、標的細胞の形質を変えることが知られており、最近では、がんを始めとした疾患への関与が注目されています。私たちはこれまで、EBV感染細胞が放出するエクソソームが、非感染細胞に取り込まれ、形質を変動させることを証明しました(Nanbo et al. J Virol, 2013)。さらに、EBV感染細胞において,エクソソーム放出量が増大すること、また、感染細胞由来エクソソームに特定のmiRNAが高度に濃縮されることを明らかにしました(Nanbo et al. Cancers, 2018)。近年、がん細胞から放出されたエクソソームが、特定のmiRNAを標的臓器に供給することで、がんの増殖や転移に関与することが報告されつつあります。そこで、現在、エクソソームが媒介するmiRNAの機能に着目して、EBV関連がん発症における役割について解析を進めています。また、エクソソームを介して血液中に放出される特定のmiRNAについて、がんの早期発見や、再発の診断のためのバイオマーカーとしての有用性が期待されていることから、EBV感染細胞から放出されるエクソソームに濃縮される特異的miRNAを対象として、EBV関連がんの診断法の実用化を目指しています。
2. 上皮系EBV関連がん発症の分子基盤に関する研究
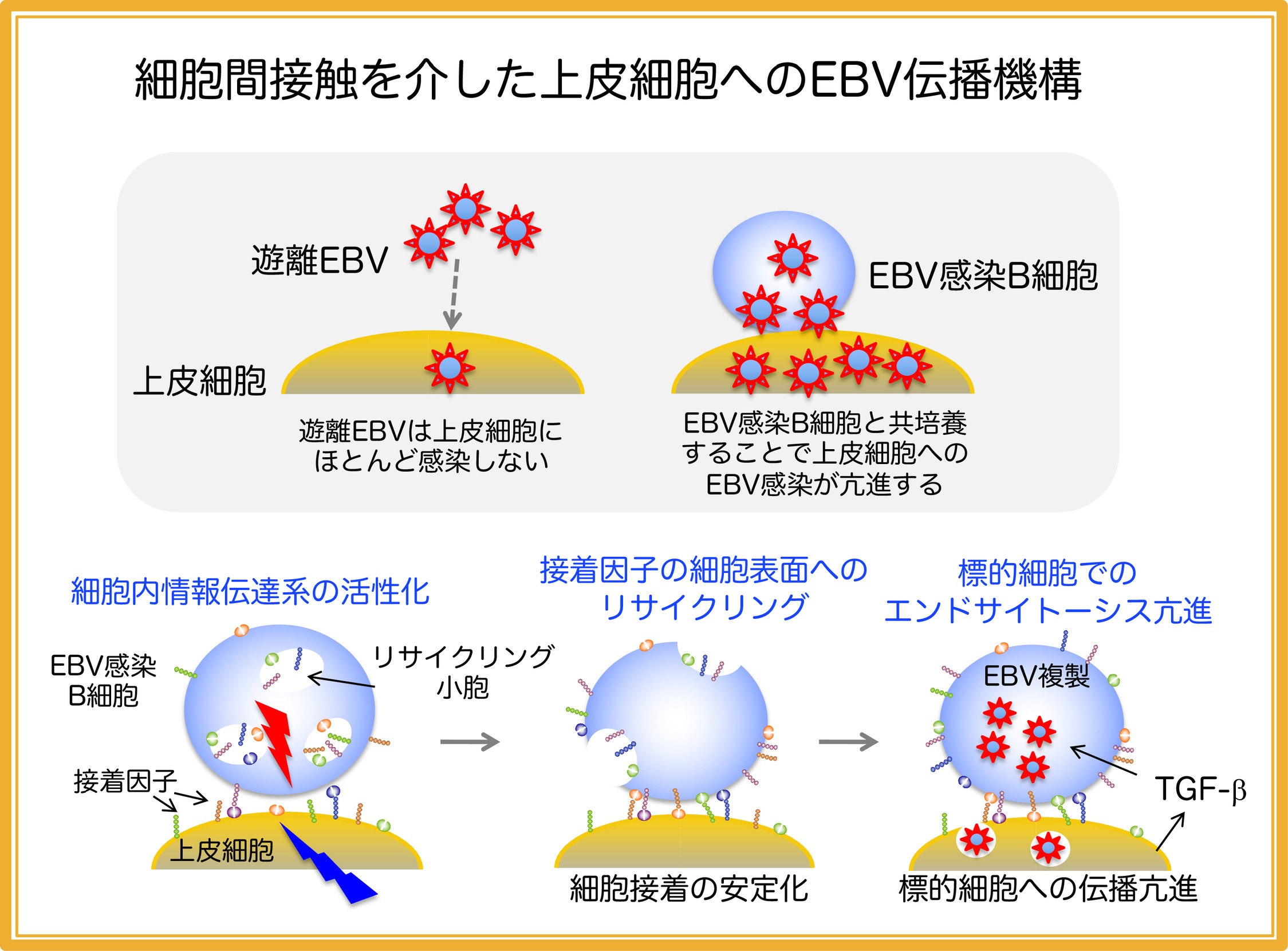
EBVはBリンパ球、上皮細胞に指向性を示しますが、上皮細胞は遊離EBVを用いた試験管内での感染に抵抗性を示すことが知られています。これに対して、EBVが潜伏感染しているB細胞との直接接触は上皮細胞への感染効率を飛躍的に増強することが知らており、上皮細胞へのEBV感染には、細胞間接触が優先的に関与する可能性が示唆されていました。私たちは、細胞間接触を介したEBVの上皮細胞への伝播に関わる分子機構の解明を試み、このプロセスにおいて、細胞内情報伝達および、接着因子、膜動態変動、液性因子が関わることを見出しました(Nanbo et al. J Virol, 2012, Nanbo et al. J Gen Virol, 2016, Nanbo et al. Front Microbiol, 2018)。EBVが関連する代表的な上皮系がんである胃がんや上咽頭がんにおいて、前がん期の組織には顕著なリンパ球の浸潤が認められるとの報告があります。そこで現在、米国と台湾の共同研究者と共に、ヒト前がん組織を用いて、上記の現象が実際に生じているか否かについて検証を試みています。
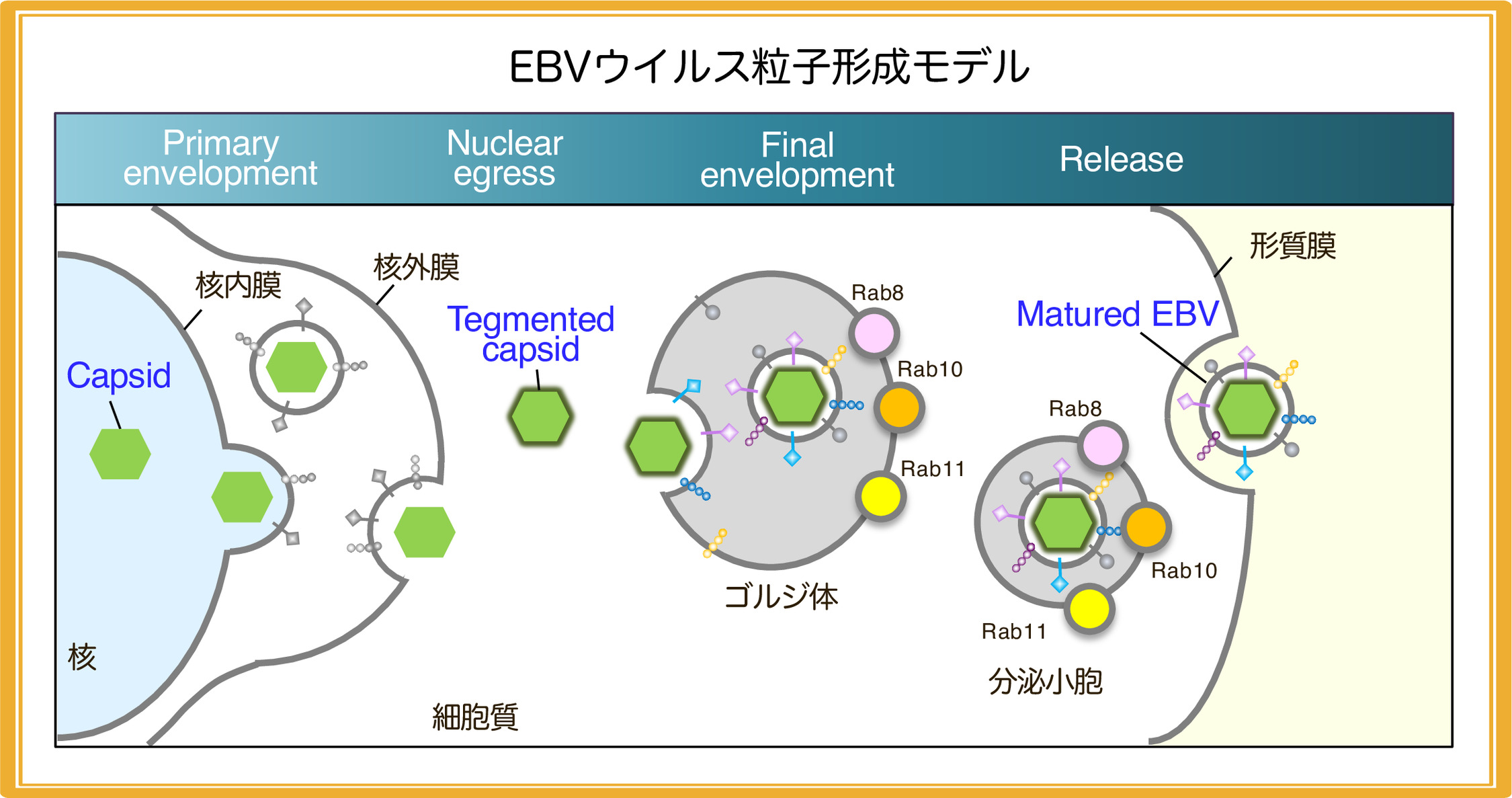
3. EBV粒子形成機構に関する研究
α, β, γの3種のサブファミリーから構成されるヘルペスウイルスは、共通して、宿主生体膜への出芽、膜融合を繰り返すことで、成熟ウイルス粒子を形成すると考えられています。まず、宿主細胞に侵入したウイルスはまず,核内でウイルスゲノムを複製しヌクレオカプシドを形成します。ヌクレオカプシドは、核内膜への出芽、外膜への膜融合を介して細胞質に放出されます。その後、ウイルス粒子に内包されるテグメントタンパク質が凝集し、且つエンベロープタンパク質が発現した細胞内小胞に出芽することで,成熟ウイルス粒子が形成されます。私たちは、成熟ウイルス粒子が形成される場がゴルジ体由来小胞であることを初めて同定し(Nanbo et al. Front Microbiol, 2018)、さらに、分泌輸送系を介してウイルス粒子を細胞外へと放出することを見出しました(Nanbo et al. Microorganisms, 2020)。現在、エボラウイルスの粒子形成に関わる経路と比較することで、多様なウイルスに普遍的に関与する膜動態現象の同定を試みています。